
医薬品、生物学的製剤、医療機器に関する書類を提出するのは大変なことです。当社の専門家がお客様の申請書類をまとめ、発行し、正しい書式で地域の規制要件を満たしていることを確認します。計画から保健当局への提出まで、すべてお任せください。

製品のライフサイクルを通じてコンプライアンスを維持することは非常に重要です。当社では、最新のコンプライアンスを維持するために、申請書類の更新、修正、更新を行います。当社の積極的なアプローチにより、規制の変更に効率的に対応することができます。
当社は、業界知識を駆使して、規制プロセスを簡素化する戦略を策定します。当社のコンサルティングサービスは、規制当局の経路を理解し、潜在的な問題を特定し、迅速な承認のためにアプローチを最適化するのに役立ちます。

当社の申請サービスにより、グローバルに展開できます。米国(FDA)、欧州(EMA)、日本(PMDA)、中国(NMPA)などの各地域で、eCTDを含むすべての申請フォーマットを管理します。お客様のグローバルな規制活動をサポートします。

当社の品質管理プロセスにより、提出書類にミスがなく、すべてのガイドラインを満たしていることを保証します。提出書類が現行の規定に準拠していることを確認することで、不合格のリスクを最小限に抑えます。
当社は、お客様の書類提出プロセスの合理化、eCTDへの移行、新興市場における規制業務のためのデータ可視化ソリューションの構築を支援します。
レギュラトリー・オペレーション・サービスの典型的なプロセスは下図の通りです。当社は、お客様のシステムまたは当社のシステムのいずれでも柔軟に対応します。以下は、eCTD提出の処理方法の例です:
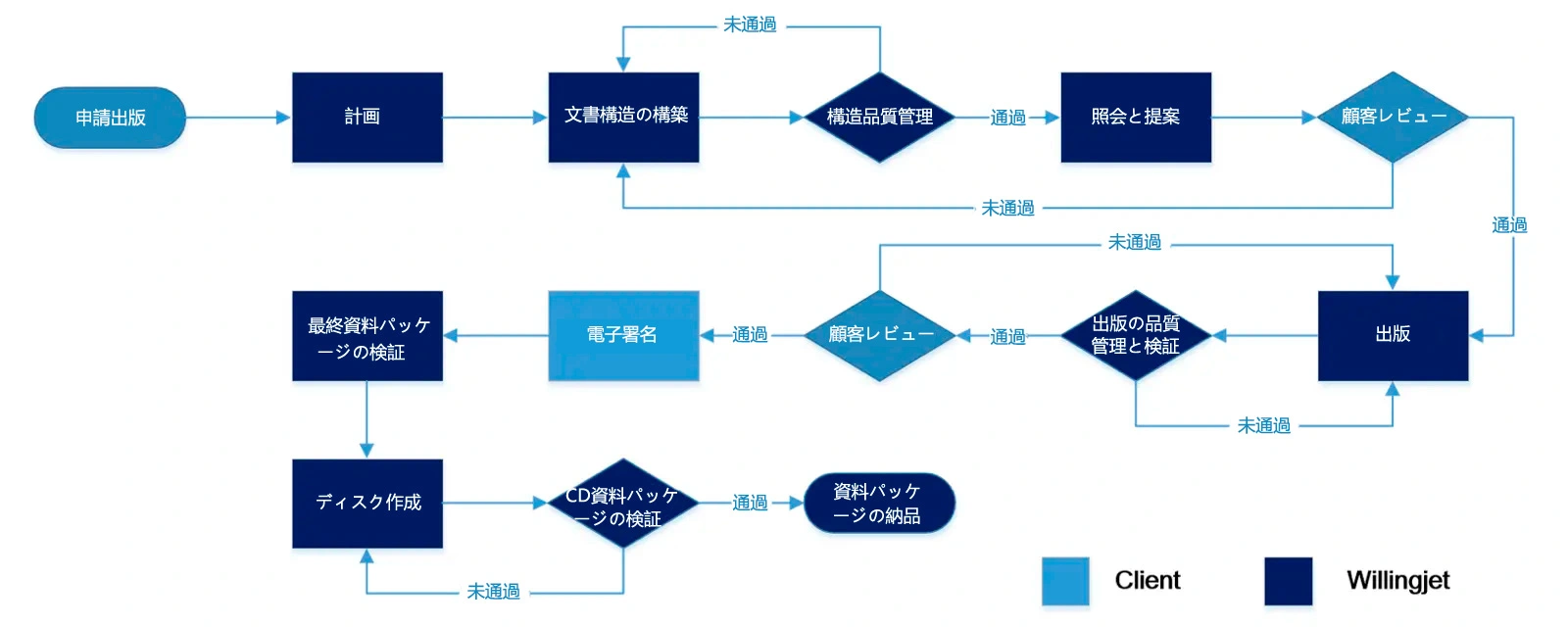
ある大手製薬会社は、新しいがん治療薬の新薬承認申請(NDA)の準備と提出の支援を必要としていました。彼らは、承認プロセスをスピードアップするためには、完璧な薬事申請が極めて重要であると認識していました。
同社は、大量の複雑な臨床・非臨床データを明確な申請パッケージにまとめ、フォーマットする必要があった。また、FDAやEMAのような地域横断的な厳しい要件に確実に準拠する必要もありました。
Willingjetと提携することで、同社はオーダーメイドの薬事業務サービスを利用できるようになりました。当社は彼らと緊密に協力し、腫瘍学と薬事に関する私たちの専門知識を活用して、戦略的な申請計画を策定しました。
1. 包括的な文書管理:当社のチームは、臨床試験データ、非臨床試験、CMC情報など、必要なすべての文書を綿密に整理し、構造化されたレギュラトリー・オペレーションのフォーマットにまとめました。
2. 規制戦略の開発:クライアントと緊密に協力し、潜在的な課題を特定し、最大の効率を得るために申請スケジュールを最適化しながら、強固な規制戦略を策定した。
3. グローバルな申請管理:FDAやEMAなど、世界各国の規制当局に提出するRegulatory Operation(規制当局への申請)の準備と管理を行い、地域ごとの要求事項への準拠を確保しました。
4. 品質保証とエラー修正:各段階で品質チェックを実施し、エラーの特定と修正を行い、規制当局からの質問に対応するための完全なサポートを提供。
1. 迅速な承認スケジュール:当社の合理化されたRegulatory Operationサービスにより、このクライアントは薬事規制の経路をうまくナビゲートし、画期的ながん治療薬の承認スケジュールを早めました。
2. コンプライアンスの保証:規制コンプライアンスに対する当社の包括的なアプローチにより、提出書類がすべての規制基準および要件を満たしていることを保証し、却下や遅延のリスクを最小限に抑えました。
3. 戦略的パートナーシップ:お客様はWillingjetとの戦略的パートナーシップにより、専門家によるガイダンス、個別のサポート、規制面での成功の実績を得ることができました。
Willingjetとの提携により、この製薬会社はがん治療薬の薬事承認を迅速化することができました。当社のサービスと専門知識により、申請プロセスが合理化され、コンプライアンスが確保され、最終的には救命治療がより早く患者に提供されるようになりました。
 登録運営とは何ですか?
登録運営とは何ですか?
レギュラトリー・オペレーションでは、eCTD、NeES、電子、紙など、準拠したフォーマットで保健機関に書類を提出します。私たちは、これらの書類がすべての要件を満たしていることを確認し、そのためにすべての部門の同僚と協力します。
 eCTDとは何ですか?
eCTDとは何ですか?
eCTD(Electronic Common Technical Document)は、医療規制当局への申請書類をデジタルで提出するための標準フォーマットです。規制当局に効率的に文書を提出するために世界的に使用されています。
 なぜeCTDの提出が必要ですか?
なぜeCTDの提出が必要ですか?
eCTDの提出により、規制当局の承認に向けた一貫性のある、整理された、効率的な審査プロセスが保証されます。FDA、EMA、PMDAなど多くの規制機関は、ワークフローを合理化し、意思決定を迅速化するためにeCTDを要求しています。
 eCTDは世界でどのように実施されていますか?
eCTDは世界でどのように実施されていますか?
eCTDは、米国、欧州連合(EU)、英国、オーストラリア、カナダなど、多くの既存市場で要求されている。GCC、スイス、南アフリカ、日本、中国、タイなどでは任意となっている。
 貴社のサービスはどのように提出資料が規制基準に適合していることを保証しますか?
貴社のサービスはどのように提出資料が規制基準に適合していることを保証しますか?
最新のガイドラインを常に把握し、包括的なチェックリストと品質保証プロセスを用いて提出書類のあらゆる部分をレビューし、すべての書類が必要な規格と形式を満たしていることを確認します。
 貴社はどのようにして私たちのグローバル提出戦略を策定するのを助けますか?
貴社はどのようにして私たちのグローバル提出戦略を策定するのを助けますか?
私たちは、グローバルな申請戦略の確立を支援し、すべてのスケジュールが守られるように複数の申請を管理します。当社は、あらゆる地域の規制業務に精通しており、お客様のグローバルなニーズをサポートします。
 提出プロセスでエラーが発生した場合はどうしますか?
提出プロセスでエラーが発生した場合はどうしますか?
当社または規制当局が誤りを発見した場合は、速やかに対処し、修正します。規制当局からの質問を管理し、必要な修正を行うことで、承認プロセスを成功に導きます。
 既存の電子提出資料の更新や修正はどのように行いますか?
既存の電子提出資料の更新や修正はどのように行いますか?
更新、修正、更新を含むeCTD提出書類のライフサイクル管理を行い、常に最新でコンプライアンスに準拠した書類をお届けします。
 貴社の電子提出サービスの利点は何ですか?
貴社の電子提出サービスの利点は何ですか?
当社のeCTDサービスは、専門知識、正確さ、そしてお客様の成功へのコミットメントによって際立っています。お客様一人ひとりに合わせたきめ細かな対応、オーダーメイドの戦略、幅広い規制知識を提供し、コンプライアンスと戦略的優位性を確保します。
 eCTDの提出はどのような部分で構成されていますか?
eCTDの提出はどのような部分で構成されていますか?
eCTD(電子共通技術文書)は、以下の5つの主要なモジュールに分かれています:
管理および処方情報:申請書や包括的な目次など、申請に関するすべての重要な詳細を網羅。
モジュール1:各地域特有の行政管理情報(申請書、カバーレター、費用情報など)。
モジュール2:薬物や製品の概要まとめ(品質、臨床および非臨床データの要約など)。
モジュール3:品質に関連し、薬物の化学、製造、制御(CMC)情報を詳細に記述。
モジュール4:非臨床試験報告書(動物や他の非臨床研究におけるデータを含む)。
モジュール5:臨床研究報告書(すべての臨床試験フェーズの詳細と結果を含む)。
当社のサービスは、提出プロセスを簡素化し、複雑さを軽減し、技術要件を管理するストレスを解消します。文書管理と提出スケジュールを最適化し、お客様がイノベーションにより集中できるよう支援します。
専門家によるガイダンスで、規制の変化を先取りしましょう。お客様の申請書類が最新の規制に準拠していることを確認し、却下のリスクを最小限に抑え、承認をスピードアップします。
当社のグローバルな申請に関する専門知識で、貴社製品の販路を拡大しましょう。多様な市場へのスムーズな参入を可能にするため、地域特有の要件をナビゲートし、グローバルな事業展開を支援します。
私たちの最適化された登録運営サービスにより、製品の市場投入時間を大幅に短縮できます。効率的な文書準備と提出戦略を通じて、承認プロセスを加速し、製品を迅速に市場に提供するお手伝いをします。
薬事専門家によるサポートで安心します。申請プロセスを通じて、各段階に応じたサポートを提供し、ガイダンスを確実にします。
データのセキュリティと完全性に対する当社のコミットメントを信頼してください。高度なセキュリティプロトコルを使用してお客様の機密情報を保護し、機密性と安全性を確保しています。

 18 11 2023
18 11 2023

 24 11 2023
24 11 2023

 06 09 2024
06 09 2024

 22 07 2023
22 07 2023